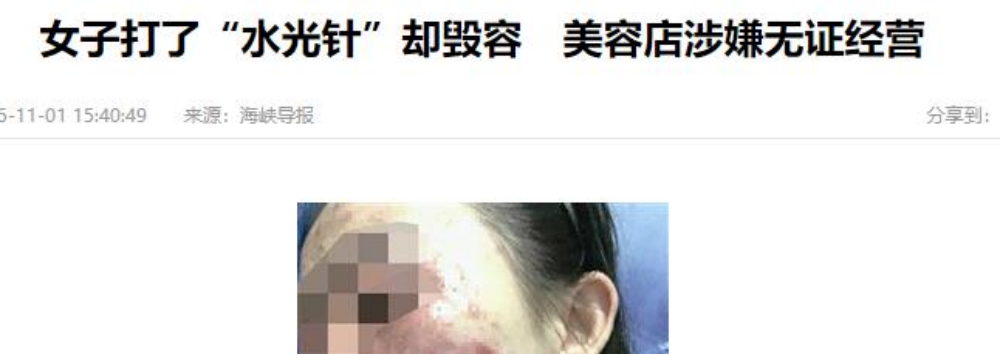
水光针出圈的背后
水光针可以说是当前认知度最高的医美项目,却屡次因假货、水货等负面新闻被央视、人民网等多媒体曝光。随着近年来国家药品监督管理局将水光针明确调整为第三类医疗器械,正式走向合规之路。然而,另一个“水光针”问题逐渐被暴露:水光针针头使用乱象丛生,多名业内人士表示,预计9成左右的医美机构都违规使用水光针针头。违规方式是:用第一类医疗器械“显微针”代替国家要求的第三类医疗器械水光针针头“一次性使用无菌注射针”。



为何商家选择用第一类医疗器械代替第三类医疗器械?
第一, 价格低。第三类医疗器械的针头价格大概为45-60元/个,是显微针的3-4倍。
第二,第一类获批数量多于第三类。药监局可查到“显微针”备案数量为32家,用于面部真皮层注射透明质酸钠的“一次性使用无菌注射针”注册数量有5家,其中国内2家,国外进口3家。
为何一类数量远远多于三类?
① 审核部门不同。境内第一类医疗器械实行备案管理,备案人向设区的市级食品药品监督管理部门提交备案资料。境内第三类医疗器械实行注册管理,由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。
② 提交资料不同,第三类注册过程复杂。
境内第一类医疗器械 | 境内第三类医疗器械 |
第一类医疗器械备案表 | 产品风险分析资料 |
关联文件(营业执照等) | 产品技术要求 |
产品技术要求 | 产品检验报告 |
产品检验报告 | 临床评价资料 |
产品说明书及最小销售单元标签设计样稿 | 与产品研制、生产有关的质量管理体系文件 |
生产制造信息 | 产品说明书及标签样稿 |
符合性声明 | 证明产品安全、有效所需的其他资料 |
境内第一类医疗器械备案需提供产品基本的资料,境内第三类医疗器械注册需证明产品对人体安全、有效,这对生产厂家要求更为严格。
③ 备案注册时间不同。第一类备案证快则1个月即可完成,第三类注册证通常要2-3年的时间。
如何从备案证号和注册证号辨别是第几类医疗器械呢?
作为消费者,根据以下方法可以很轻松辨别:
①带有省市简称+备字样的,为国内第一类医疗器械;②带有省市简称+注字样的,为国内第二类医疗器械;③带有国+注字样的,为国内第三类医疗器械。
本公司是一家国家三类医疗器械生产公司,从原材料到生产环境处处把关,严格管控,严格按法规要求执行,进而保证产品最终质量。目前,本公司正在研发用于水光针注射的针头,预计2023年完成注册,成为国内第3家拥有用于面部真皮层注射透明质酸钠的“一次性使用无菌注射针”注册证的生产厂家,本公司势必将合规之路走到最后。